
このサイトは、日本国内の医療関係者(医師・看護師・検査技師・栄養士・薬剤師など)の方に当社商品に関する情報を提供することを目的としています。
日本国外の医療関係者および一般の方に対する情報提供を目的としたものではございません。
あなたは医療関係者ですか?
製品・サービス
APOE 遺伝型キット PrismGuide™ APOE 遺伝型判定キット
抗アミロイドベータ(Aβ)抗体薬投与で生じうる副作用の1つであるARIA※1 (アミロイド関連画像異常)発現リスクの判定を補助します。
※1 ARIA:Amyloid-Related Imaging Abnormalities
【全般的な注意】
1. 本品は体外診断用医薬品です。これ以外の目的には使用しないでください。
2. 本品によるAPOE遺伝型の判定結果のみで治療方針の判断を行わず、他の関連する検査結果や臨床症状等に基づいて総合的に判断してください。
3. 本製品の電子添文以外の使用方法については保証をいたしかねます。
4. 測定に使用する機器の添付文書及び取扱説明書をよく読んでから使用してください。
5.「 認知症に関するAPOE遺伝学的検査の適正使用ガイドライン」1)を良く理解した上で検査を行ってください。
電子添文
最新の電子添文は こちらをご覧ください。
基本情報
製品概要
| 使用目的 | 全血より抽出したゲノムDNA中のAPOE遺伝型判定(ARIA発現リスクの判定の補助) |
| 貯蔵方法 | −25℃ ~ −15℃で、暗所にて保存 |
| 有効期限 | 製造後12カ月 |
| 包装単位 | 180テスト/箱 |
| 構成品(略称) | Reaction Mix 1(Rx 1) Reaction Mix 2(Rx 2) Internal Standard Allele 1-HEX(ISA 1-H) Internal Standard Allele 1-FAM(ISA 1-F) Internal Standard Allele 1-MIX(ISA 1-MIX) Internal Standard Allele 2-HEX(ISA 2-H) Internal Standard Allele 2-FAM(ISA 2-F) Internal Standard Allele 2-MIX(ISA 2-MIX) No Template Contro(l NTC) |
測定試料
全血(EDTA-2K, EDTA-2Na血液)より抽出したゲノムDNA
使用するリアルタイムPCR装置
アプライドバイオシステムズQuantStudio 5 Dx
(ライフテクノロジーズジャパン社、製造販売届出番号:13B1X10227000007)
測定原理と検出対象
測定原理
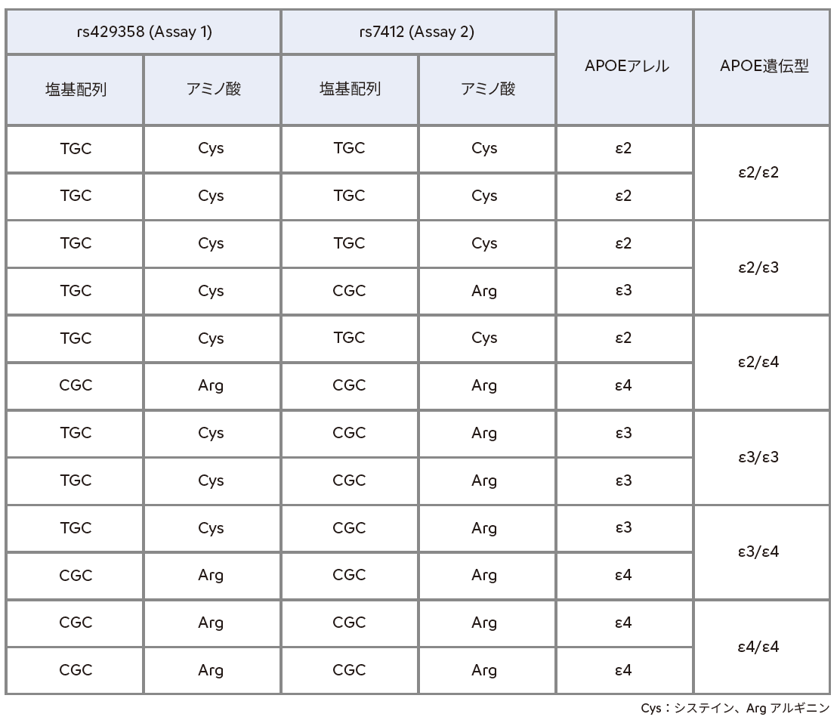
本品は全血から抽出したゲノムDNAを試料として、リアルタイムPCR法を用いてAPOE遺伝子の2箇所(rs429358及びrs7412)の塩基配列の違いを検出し6種類のAPOE遺伝型を判定します。
抽出対象
臨床性能試験成績
アルツハイマー病による軽度認知障害及び軽度の認知症を対象としたレカネマブの第Ⅲ相試験(Clarity AD試験)の検体を150検体(プラセボ群:60検体、レカネマブ群90検体)用い、Clarity AD試験で実施したAPOE遺伝型検査法を対照法としたときの試験法のAPOEε4保因状況(ノンキャリア、ヘテロ接合型キャリア、ホモ接合型キャリア)別の判定一致割合及びAPOEε4保因状況におけるARIA発現検体の割合を評価しました。
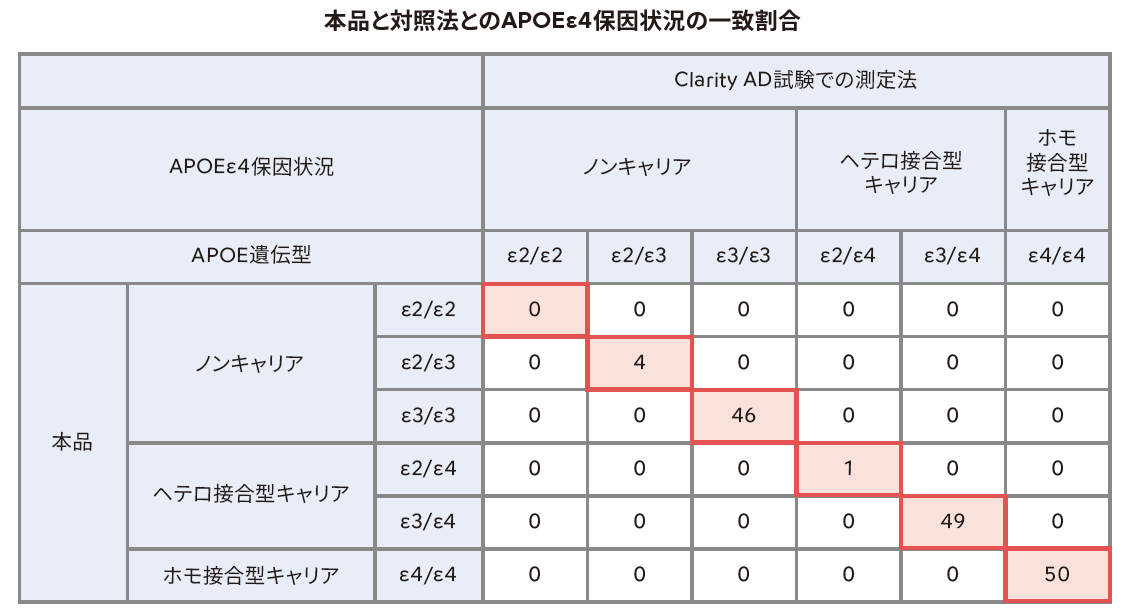
APOE4保因状況の全体一致割合 :
APOE4保因状況別の一致割合 :
100% [95%信頼区間 : 97.6% - 100%]
APOE4保因状況別の一致割合 :
ノンキャリア : 100% [95%信頼区間 : 92.9% - 100%]
ヘテロ接合型キャリア : 100% [95%信頼区間 : 92.9% - 100%]
ホモ接合型キャリア : 100% [95%信頼区間: 92.9% - 100%]
最小検出感度
10 ng/test(2 ng/L)(ゲノムDNAとして)※2
※2 アプライドバイオシステムズ QuantStudio 5 Dx使用時
※2 アプライドバイオシステムズ QuantStudio 5 Dx使用時
製品パンフレット
※資料送付をご希望の場合はページ下部「お問合せ、資料請求フォーム」よりご請求ください
参考文献
1) 「認知症に関するAPOE 遺伝学的検査の適正使用ガイドライン」「認知症に関するAPOE 遺伝学的検査の適正使用ガイドライン」作成委員会 監修:日本認知症学会,日本老年精神医学会,日本神経学会,日本精神神経学会,日本老年医学会,日本神経治療学会,日本遺伝カウンセリング学会
初版 2025 年3 月31 日

