このサイトは、日本国内の医療関係者(医師・看護師・検査技師・栄養士・薬剤師など)の方に当社商品に関する情報を提供することを目的としています。
日本国外の医療関係者および一般の方に対する情報提供を目的としたものではございません。
あなたは医療関係者ですか?
がんリンパ節転移診断システム(OSNA™法) 遺伝子増幅検出装置 RD-200/100i
特長
「OSNA™」と「現行法」の違い
現行法による検査の場合
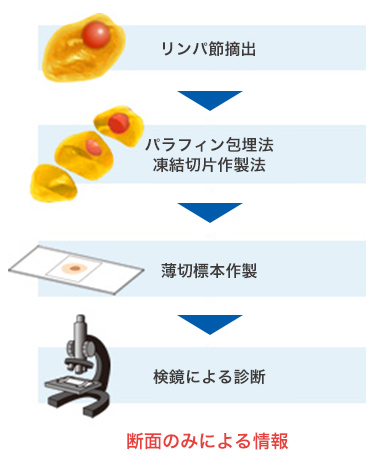
【病理組織調査】
手術中に病理医が
顕微鏡でがん細胞の有無を確認
病理組織学的アプローチであるこれまでの方法では、専門病理医の技術や経験に頼るところが大きく、限られた時間での検査には施設間差があるといわれています。
課題とされる点:
課題とされる点:
- リンパ節の一部のみの検査のため、がん転移を見つけられない場合がある
- 手術中という限られた時間でのきめ細かな観察が必要
- 正確な判定には、専門病理医の技術と経験が必要
OSNA™法による検査の場合
現行法による検査の場合
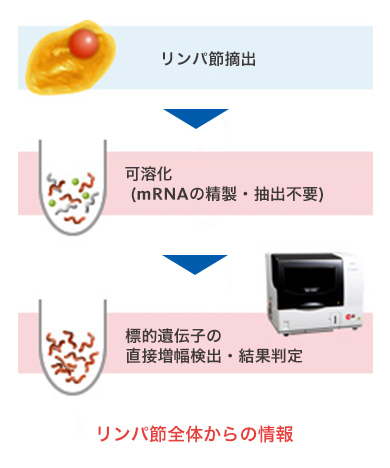
【OSNA™法(One-Step Nucleic Acid Amplification法)】
専用の装置と試薬で
がん細胞の遺伝子を増幅して測定
リンパ節全体を可溶化して検査するため、より正確な判定が可能です。検査開始から完了まで約30~40分と術中検査に使用できます。また、検査を自動化できるため、病理医の手技や熟練度による施設間差を解消することができます。
所要時間:約30~40分
メリット:
- リンパ節全体を検査するため、より高精度に判定が可能
- 短時間で検査結果を得られるため、手術中の検査が可能
- 検査を自動化できるため、測定方法の施設間差を解消
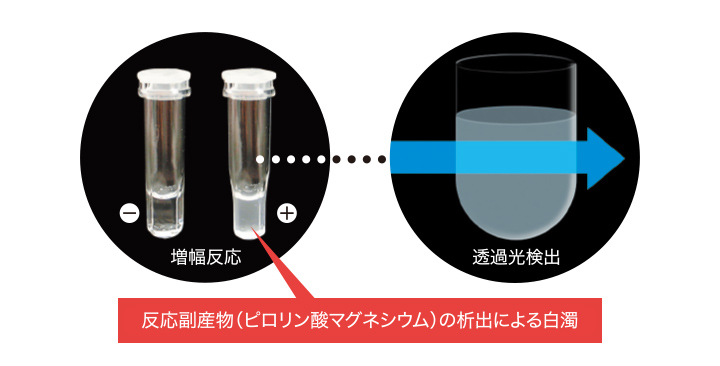
標的遺伝子の検出方法
リアルタイム濁度検出
OSNA™法で遺伝子増幅法として採用しているRT-LAMP法*では、標的遺伝子の遺伝子増幅に伴い反応副産物としてピロリン酸マグネシウムが析出します。専用の解析装置RD-100iは、この反応副産物の析出による濁度の変化をリアルタイムに検出しています。
* RT-LAMP法(Reverse Transcript Loop-Mediated Isothermal Amplification method)
当社はLAMP法の使用に関して栄研化学株式会社と2001年1月に実施権の許諾契約を締結しております。
当社はLAMP法の使用に関して栄研化学株式会社と2001年1月に実施権の許諾契約を締結しております。
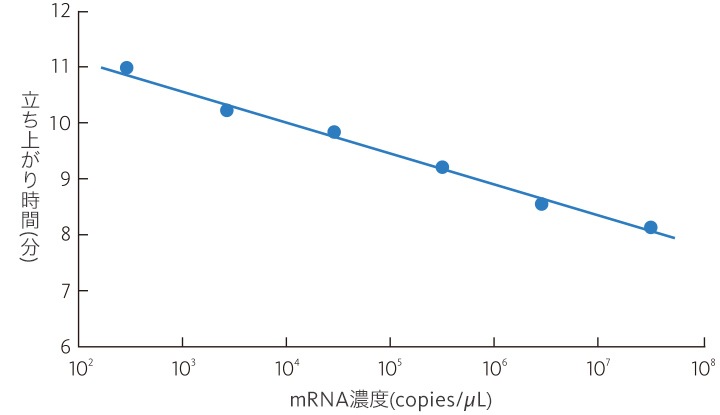
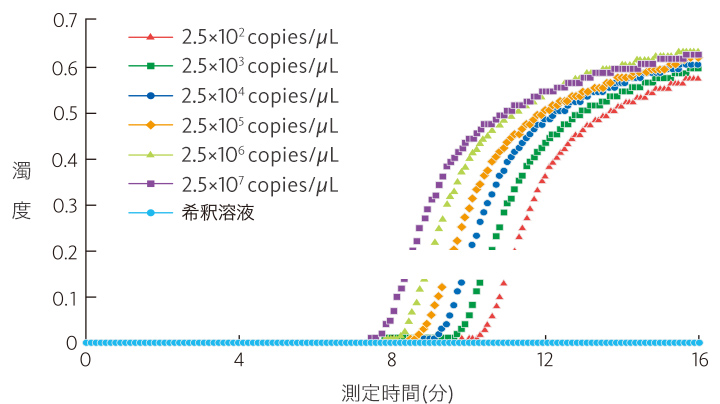
mRNA濃度と立ち上がり時間との関係
リアルタイム検出している濁度がある閾値(0.1)に達した測定時間を「立ち上がり時間」としています。この「立ち上がり時間」はmRNA濃度(copies/μL)と相関関係があるため、予めmRNA濃度既知のキャリブレーターを用いて検量線を作成する事で、未知の測定サンプルの「立ち上がり時間」からmRNA濃度の定量が可能です。
RT-LAMP法の増幅曲線
mRNA濃度(copies/μL)が高いほど立ち上がり時間が早い
「立ち上がり時間」とmRNA濃度の関係
mRNA濃度(対数値)と「立ち上がり時間」は直線関係となり、これを検量線として測定サンプル中のmRNA濃度を算出します。
※実際には濃度既知の3点のキャリブレーターを用いて検量線を作成します。